みなさま、こんにちは。今回は、COGNANOが取り組む次の二つの重要なプロジェクトについてご紹介いたします。
- VHH Epitope Prediction Challenge
- 膵がんマーカー抗体の無償提供
どちらも、私たちが構想する “完全自動創薬” の完成を目指す挑戦の一環であり、次世代創薬技術に関心を寄せる皆さまにとって重要な意味を持つと確信しています。まずは、COGNANOが描く創薬の未来像からご説明させてください。
COGNANOが構想する「完全自動創薬」の本質
創薬とは、単に新物質の発明ではなく、病気の本質を理解し的確に作用する治療手段を提案するという、知の総力戦です。その出発点は、分子あるいは細胞単位で疾患の特徴を理解し、真に効果的な標的分子=バイオマーカーを見出すことです。
現在、バイオマーカー探索基盤とされているゲノミクスやプロテオミクスでは、がんでさえ、明確な標的を網羅的に同定するには至っていません。アルツハイマー病や自己免疫疾患などに至っては、分子レベルでの病態把握自体が難しいのが現状です。
こうした課題に対して、COGNANOは「Structure-Omics(ストラクチャー・オミクス)」という新しいアプローチを提案しています。Structure-Omicsでは、疾患の特徴を「分子構造の異常」と捉え、網羅的に探索するために、VHH抗体をプローブとして活用します。VHH抗体はアルパカ由来の特殊抗体であり、微細な構造差異を高精度に識別できる能力があります。これを用いることで、従来の手法では捉えきれなかった疾患特異的構造を、抗体が“自動的に”教えてくれる仕組みです。(なぜVHH抗体なのか?は記事下部にコラムを記載しています)
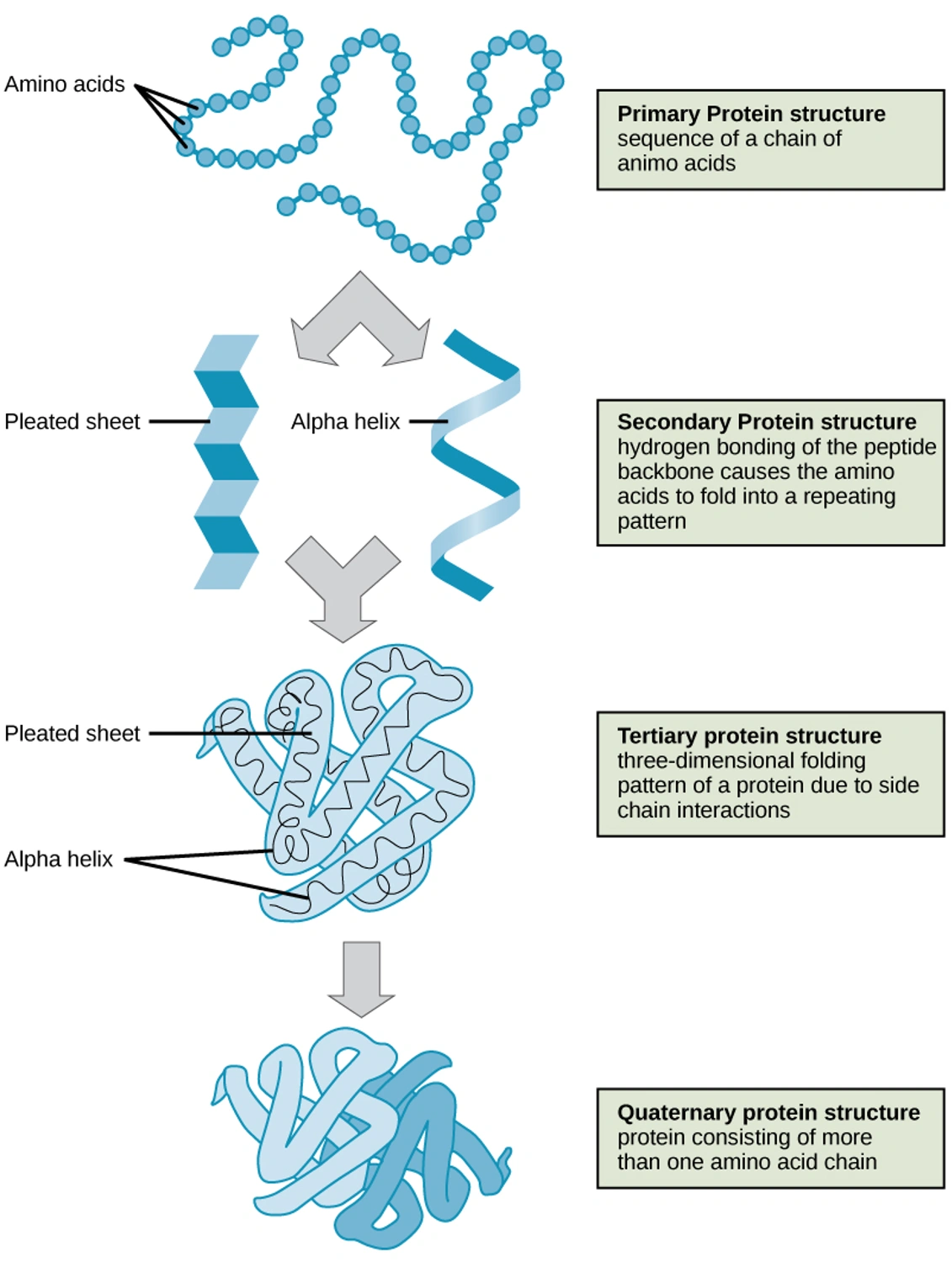
下の図は、アミノ酸の鎖が折りたたまれて立体構造をとり、分子同士が複合体を形成する原理をヘモグロビンを例として説明したものです(上から下方向に高次構造をとる流れ)。汎用的な構造情報(正常構造)は手に入るようになりましたが、疾患特異的な構造を予測するためのデータベースは存在しません。
なぜ「自動創薬」は実現できなかったのか
近年、DeepMindによるAlphaFoldの成功を皮切りに、AIによるタンパク質の三次構造予測が飛躍的に進歩しました。AlphaFoldの登場は、構造生物学に革命をもたらし、ノーベル賞にもつながる成果となりました。
以下の表は、現在信頼されている立体構造予測アルゴリズム(誰でもインターネット経由で使用することが可能)のリストです。COGNANOのデータとの補完性と推奨例を追加記載しています。
アルゴリズム | 強み | 限界 | COGNANOデータ との補完 | 推奨 ユースケース |
AlphaFold (DeepMind) | CASPで高精度 複合体対応 | ダイナミクス・微細エピトープに弱い、計算負荷大 | 実測ラベルで予測安定度を較正、ヒット候補のランク修正に有効 | 既知標的の構造同定と結合位相スクリーニング |
RoseTTAFold (Baker Lab) | オープン性・拡張性・軽量実装 | 単体精度はAF未満、改善はコミュニティ依存 | 抗原別分布で過学習監視、抗原切替の高速検証に貢献 | 多数抗原×多数クローンの並列PoC |
ESMFold (Meta FAIR) | LLMで高速、大規模スクリーニングに適性 | 相互作用の精緻さ不足、機能予測未対応 | 巨大“負例”で生成候補をフィルタ、多様性確保 | de novo配列生成の粗スクリーニング前段 |
しかし、この成果をもってしても、創薬の自動化には至っていません。その理由は明確です。
- これらは“正常構造予測”のアルゴリズムであり、“疾患標的の発見”はできません。
- 病気のときにだけ現れる“特殊な構造”を含んで集積した元データが存在しません。疾患情報源としての「マップ」「辞書」がないということです。
したがって、真に自動創薬システムを志すチームは、疾患標的の発見に最も注力すべきであり、そのためには自ら新たな“構造データベース”を構築するしかないのです。これが達成できれば、次の段階で、Alphafoldなどが有効な新物質を生成してくれるはずです。
COGNANOはなぜ創薬を自動化できるのか?:抗体が語る“病気の地図”
COGNANOは、単鎖抗体生物であるアルパカに疾患由来細胞や変異タンパク質を10年にわたり免疫し続け、全抗体情報を網羅的に集積することにより、疾患細胞に特異的に出現する特殊な構造を探索し、バイオマーカーとして体系化する取り組みを進めてきました。すでに、膵がんや胆管がん、トリプルネガティブ乳がんなど、複数の難治性がんに対し、世界初となる「構造バイオマーカー群」の確立に成功しています。
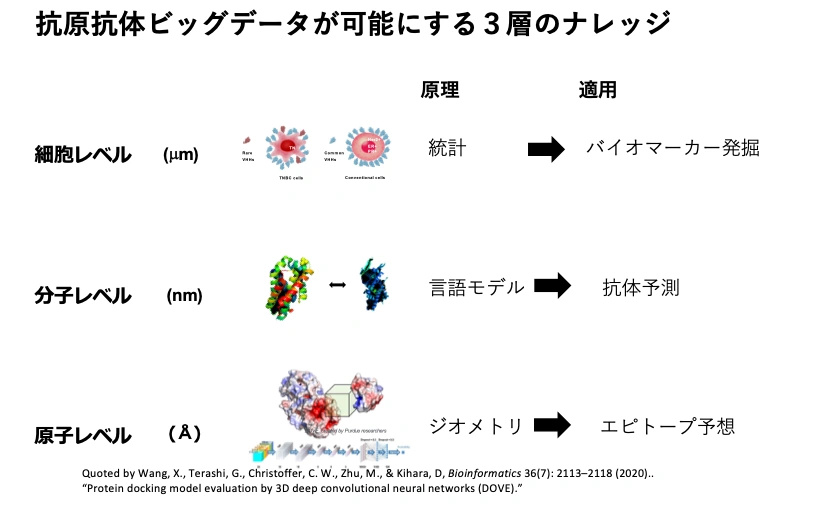
この抗体群は、情報となるばかりか物質として実体化され創薬シーズとなり、抗体医薬としてすぐに開発に着手できる状態にあります。また、構造の特徴が同時に得られるため、リード最適化や副作用予測も加速されます。COGNANOは、これを“完全自動創薬”の起点と捉えています。
最後の難関「エピトープ予測」を世界に問う
私たちが現在抱えている唯一の課題は、得られた抗体の配列から、どのエピトープに結合しているかを正確に予測する技術が確立されていない点です。このピースがはまれば、創薬の所要期間をさらに1-2年短縮できます。
この課題に挑戦していただくため、COGNANOは2026年、「VHH Epitope Prediction Challenge」を開催します。対象は、Her2分子に対する6種類の抗体配列。参加者は、配列情報から結合部位を予測し、その正確性を競います。アプローチは自由。AlphaFoldを使うもよし、独自モデルを構築するもよし。挑戦者には賞金が贈られ、優秀者は世界の創薬エコシステムで評価されるでしょう。
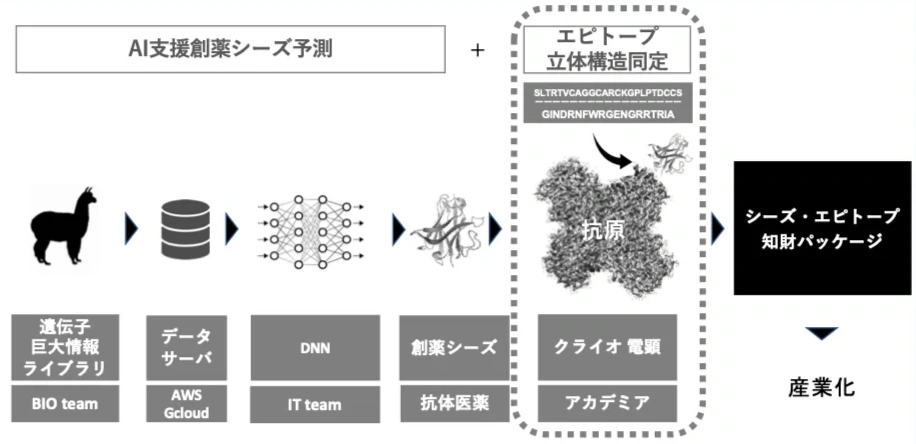
図は、アルパカのシングルドメイン抗体のビッグデータから、未知の標的分子を炙り出し、最適な抗体をシーズとして創発するCOGNANOプラットフォームのフローです。今回の「VHH Epitope Prediction Challenge」は点線箇所を解決するタスクになります。
膵がんマーカー抗体パネルの無償提供
さらに、COGNANOはすでに確立された「膵がん特異的マーカー抗体」を、世界の研究者に無償提供するプログラムを開始します。これは、特に膵がん領域において、明確なバイオマーカーが未だ存在しないという臨床的課題に応えるものです。公的機関と連携し、non-profitな形で提供し、希望者にはデータの共有と研究成果の公開をお願いする方針です。
全ての創薬が自動化される未来へ
創薬の自動化は疾患標的の壁に阻まれてきました。創薬業界の課題である、Unmet Medical Needsという概念のほとんどは、疾患標的が定義できない問題に遡ります。現代では、疾患標的の分子が決まれば、Alphafold3などのアルゴリズムによって薬剤候補生成が可能になりつつあります。COGNANOは、疾患標的同定の壁を免疫システムという自然の叡智によって克服します。私たちは自然の免疫システムをデジタル情報に変換することにより、疾患標的を網羅的に発見します。目的は、細胞や分子における正常と異常の違いを見分けることです。ゲノムであろうと、アミノ酸変異であろうと、分子構造であろうと、疾患特徴を見分けることができれば、自動創薬は可能になります。COGNANOは未到達であった「疾患構造データベース」を一歩ずつ着実に築いています。
AI研究者・医療関係者・投資家の方へ
どうか、「VHH Epitope Prediction Challenge」に共感し、参加していただけるAI研究者・医療関係者・投資家の皆さま、このトライアルの一翼を担ってください。COGNANOは変革の先陣を切り、皆様と共に進みます。

株式会社COGNANO (VHH Epitope Prediction Challenge事務局)
問い合わせフォーム:https://www.cognano.co.jp/contact
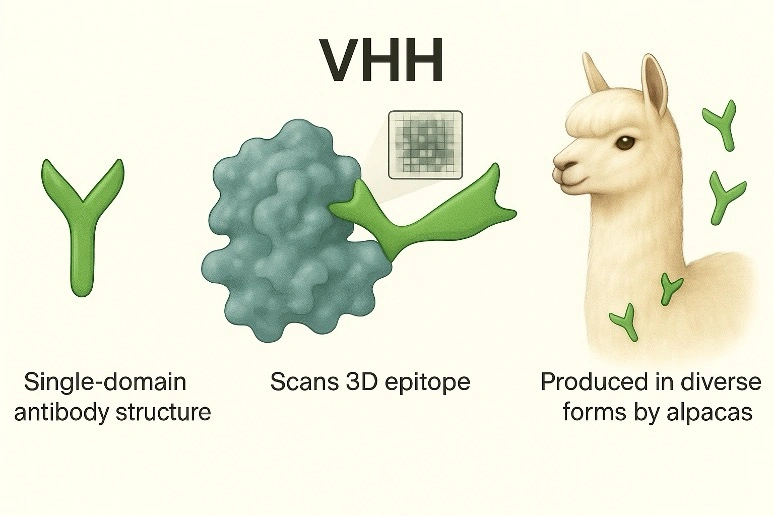
1. シンプルな構造で効率的なデータ解析が可能
ラクダ科動物(アルパカなど)の抗体の一部は重鎖のみで構成されています。これにより、抗体遺伝子の解析が簡単になり、次世代シーケンサを用いた解読コストを大幅に削減できます(通常抗体解読の100万分の1)。得られたアミノ酸配列は、まるでバーコードのように利用でき、深層学習によるデータ分析に活用できます。
2. 小さなターゲット空間に届く
VHH抗体は一般的な抗体サイズに比べて極めて小さく、複雑な構造を持つ標的にも効率的にアクセスします。特定のVHH抗体は標的分子の構造的特徴を正確に反映することから、対象をスキャンする3Dピクセルとして運用可能です。
3. 生体内の自然な多様性が最大の強み
アルパカのような中型動物においては、1兆個以上のリンパ球が常に新しい配列の抗体を生成し進化させています。生体内でしか再現できない膨大な多様性と、優れた抗体を選び出す機能が、VHH抗体の最大の価値です。動物に苦痛を与えずに得られる生体リアルデータは、試験管内操作では決して再現できない質と量を保証します。

