はじめに
COGNANO代表の伊村です。まずは、今回のブログ本編を執筆した前田部長の紹介をさせてください。
ダイアモンドプリンセス事件を知った時、COGNANOは新型コロナ創薬に舵を切りました。以来、クスリ開発だけではなく、「ウイルス変異」を追跡するトラッキング創薬原理の開発や抗体情報巨大ライブラリの構築に向け、すでに2年以上プロジェクトを続けています。寝食を忘れ戦い続けたのが、研究開発部の前田部長です。遺伝子工学、タンパク質・抗体工学、構造学を武器に、新しい手法で切り込むバイオイノベーターです。
2020年9月には「1年後に出現することになるオミクロンにも有効な抗体」をすでに発掘していましたが、バイオジャーナルの査読に時間を費やし、論文が受理されたのは1年半後になりました。このブログではジャーナルのピアレビューシステムの是非には触れません。とはいえ今回の「アルパカ抗体」論文公開は良い機会ですので、2年間の振り返りをブログに記述します。前田部長は、論文の筆頭著者でもあります。
お疲れ様!と言いたいところですが、コロナは全く終わっていません。当然、バイオサイエンスと社会運用は同じではなく、一元的な解決は望めません。世間では「うんざりだ」という感覚と、先行き見えない不安で、どう向き合ったらよいか、肚を決められなくなっている印象があります。
その意味では、バイオ&ITテックとしてのCOGNANOがやるべきことはスタートからはっきりしています。ウイルス変異は人間の予想を超える以上、人類がデータと計算力でどこまで食い下がれるのか、そして、万一毒性が強くなっても対策が打てるのか、を突き詰めることです。今やCOGNANOでは、2年以上蓄積し続けた膨大な抗体データと計算力がお互いに強化し合う段階に入っており、ウイルスゲノム変異をトラッキングすること自体に数学的な価値があると考えています。これは、世界でCOGNANOだけが進めているプロジェクトです。
変異に対応する多様な抗体データは、変異型を認識する個体(ヒトであれ動物であれ)からしか取得できないのですが、ヒト抗体遺伝子の解読には次世代シーケンサ(NGS)が使えないので、ラクダ科動物経由でしか、大量の抗体情報をトラッキングできないからです。人類とウイルスの生存競争(生存協調?)の中でリアルに選択される相互変化(ウイルス変異と抗体多様性のデータペア)は、100年に一度しか得られない「自然が与えてくれた稀有なチャンス」です。宇宙研究者が、まれにしか観察できない超新星爆発のデータを取らない、という判断があり得るでしょうか?
前田が記述していますが、20年前のSARS-CoV1のデータを(部分的であれ)生かした米国のチームが抗体創薬における勝者だった事実が、厳格なルールを証明しています。目を逸らす人々に勝機は訪れないと、今回のブログは語っています。現在、オミクロンBA.5, BA.2.75(ケンタウロス)など変異が進行しており、その全てをトラッキングしながら通用する抗体をぼくらは探し続けています。今回の前田ブログは、バイオ開発者が振り返る貴重な記録になると思います。
それでは、前田部長の本編へどうぞ。

正しい研究者の共通点
「正しい」バイオマン、特に生化学者には、共通の特徴があります。まず興味のあるタンパク質を精製することができます。精製したタンパク質には、予想通りの生理活性が認められます。ときには、タンパク質の結晶すら作れます。残念ながら、このタイプの「地道な」生化学者は、今や絶滅の危機に瀕しているかもしれません。正統なプロは他人が作ったタンパク質をつかいません。もとより、市販されているタンパク質など信じていません。生化学のエキスパートは、生体から精製されたものを至高のものとし、培養細胞から精製されたものを次善のものとします。ほかの生物種由来のタンパク質は、ヒト創薬を前提とする場合、適切ではないリスクや誤謬が増大します。現代でも職人技が要求される、神経を使う領域です。
プロであれば、未知のタンパク質―新型コロナスパイク―こそ、ベストの方法で挑みます。パンデミックがはじまり、世界中の生化学者たちが、スパイクタンパク質を精製する、という課題に取り組みました。これが「正しい」生化学の姿勢です。目的は、スパイクタンパク質を理解し、ウイルスを無力化することでした。
蓋を開けてみると、新型コロナウイルスの研究をリードしたのは2002年からSARSを扱っていたエキスパートでした。彼らは10年以上にわたる「旧型」スパイクタンパク質への経験がありました。そして、新型コロナスパイクタンパク質の精製と構造決定にいち早く成功しました。
当時アメリカでは感染者は出なかったにも関わらず、防疫部は「War」と表現しています。実は日本の感染防御部門も着目しており、当時の記載が残っています。バイオ脅威に対するセンスの違いは潜在しているかもしれません。
新型コロナに感染し回復した患者さんには、免疫応答によって、ウイルスを無力化する抗体ができています。精製した新型コロナスパイクタンパク質を使って、その抗体を集めることができます。その抗体を作る細胞(リンパ球)の遺伝子を解読することで、新型コロナスパイクタンパク質を無力化する抗体をリストすることができました。
英米では複数の拠点がシームレスに整備されていた
もっとも初期に成功したのは、米国英国の研究グループでした。なぜ彼らだけができたのかには、明確な理由があります。彼らは、エイズウイルスやエボラウイルスなどを無力化する抗体を見つける方法を、パンデミック以前から作り上げていたからです。患者サンプルをシェアできる態勢、リンパ球を分別(ソート)して遺伝子を解読する技術、抗体を大量に精製できるパイプライン、承認の透明性と使用に責任を持つ制度。これらのシームレスなインフラを整備していたのです。
後を追うように、同様の研究が世界数百のアカデミア、ベンチャーによって進められました。トップチームに追いつくことができた研究チームも欧米英にはありましたが、追い抜くことはできませんでした。そして、2021年11月26日の新型変異株(オミクロン)の出現後も「生き残った」のは、パンデミック以前から研究を続けていたグループだけでした。事実として、オミクロン変異型ウイルスも無力化できる抗体(市販されている製品)は、SARS-CoV1(旧型コロナ)に感染して回復した患者保存サンプルから発掘したものです(GSK社製ソトロヴィマブ)。やはり、20年にわたる経験の差を埋めることは、相当に難しかったのです。結果として、欧米英以外の地域では、ほぼワクチンや創薬の能力がないことが明瞭になりました。

成功を約束する経験とは
ここでいう「経験の差」とは、一体どのようなものでしょうか。いくつかの要素に分けて、捉えることができます。
- 新型コロナスパイクタンパク質の品質(生化学)
- 抗体免疫の遺伝子資産(抗体の遺伝子ライブラリ)
- 抗体のアミノ酸配列データの解析量(プログラミング)
- 実証実験の組み方(ウェットバイオ・ウイルスの扱い)
新型コロナスパイクタンパク質は、少なくとも哺乳類細胞に発現させた特級品である必要があります。うまくいかなかった研究グループは主に以下のものを使っていました。新型コロナスパイクタンパク質の一部に過ぎない、受容体結合ドメイン(RBD)。昆虫細胞で発現させたスパイクタンパク質。市販品。これらは創薬の成功率を低下させる原因となります。
抗体を作る生物としては、回復した感染患者(ヒト)が至高です。次善は、ワクチンを打ったヒトや、感染または免疫した動物です。成功しなかった研究グループは、十分に免疫されなかった動物を用いたり、さらには免疫すらしていない動物のリンパ球遺伝子(ナイーブライブラリ)から抗体を見つけようとしました。
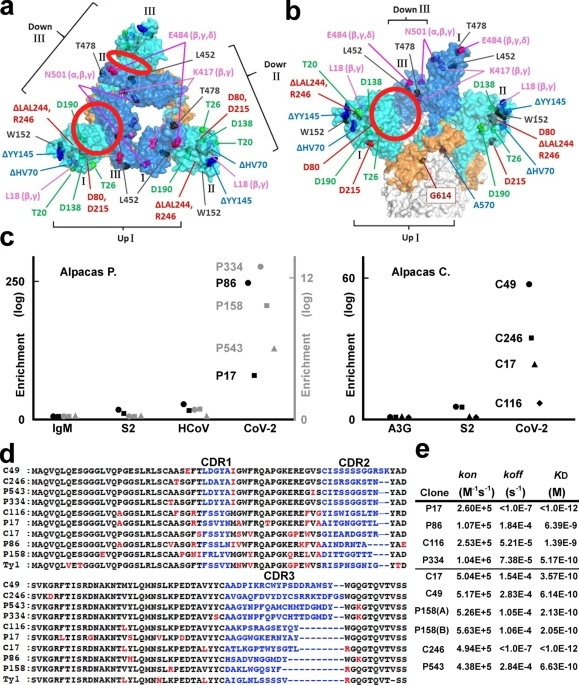
抗体の優秀性は、どのくらい発掘(遺伝子ライブラリからのマイニング)に労力を注いだかに相関します。患者さんから探しだせる抗体遺伝子の数は、世界最高の研究チームにおいても数十個が上限でした。研究用マウスからは百個のオーダーが上限です。一方で、免疫する動物にリャマ、アルパカ、ラクダを用いた研究グループは世界に10チーム程度あり、数万から数千万種類の抗体を探索することができたはずです。COGNANOではスパイクタンパク質を認識する抗体を3千万種類次世代シーケンサで分析して蓄積しています。ただし、この種の研究は始まったばかりで、世界でもようやく数チームが気づいたばかりです。私たちは莫大な抗体データを取ることができるようになった初めての世代ですが、データの次には「計算処理する」ためのITテクノロジーが要求されます。この先頭にCOGNANOは位置しています。
最後に、発掘した抗体がウイルスを無力化するかどうか、実験的に検証してみなければなりません。患者さんに投与して効果を見ることが至高の方法です。とは言え、人体で実験するわけにはいかないので、感染動物に投与する方法が次善の方法です。ミミック手段として、ウイルスに感染する培養細胞を用いる方法は、再現性良く定量的な方法です。しかしあくまで試験管内の現象にすぎない点に留意すべきです。さらに大切なことですが、抗体がスパイクタンパク質のどの部分に結合するか(エピトープ)を知ることも、とても重要です。なぜなら、抗体がどの変異株に有効で、新型変異株に無効になるか、ロジカルにわかるからです。抗体がスパイクタンパク質に結合している様子を撮影する技術(クライオ電子顕微鏡)が、国内では今回大阪大学で稼働し始めたのですが、欧米では数年前からアカデミアと製薬が協力して標準的な作業になっていました。成功したグループはどこも、当然のようにウイルス感染実験を行っており、かつ世界標準レベルでエピトープ決定を行ないました。これらの項目をシームレスに満たせる......ということが、勝者共通の能力であり、先進国で用意されたファシリティでした。
これら4つの要素を満たした研究グループのみが、登頂へ進むことができたのです。そして、オミクロン株の出現によって、敗れ去った研究グループには、それぞれに理由がありました。各グループが発表した論文をひもとくと、なぜ最善を尽くせなかったのか、行間にその理由が書かれています。ウイルスタンパク質製造に関して最善を尽くせず敗退した研究グループは8割以上にのぼります。加えて(ヒト・動物に)免疫しない方法から出発したグループで成功した例はありませんでした。
天国へ行ける者は、地獄への道を知り尽くしている者である
新型コロナウイルスの研究に限らず、「成功するチーム」はどれもみな似通っているものです。古人曰く、
天国へ行ける者は、地獄への道を知り尽くしている者である
勝者は、10年前から、どうしたら失敗するのかを身を以て体験し、コストを払い、諦めなかったチームに限られました。結果として、勝者は英米(の会社とアカデミア)にほぼ限定されていました。以上が、パンデミックという名の戦争ではっきりした事実です。この課題を、私たちはどう受け止めるのか、真剣に考える時がきていると思っています。(前田良太・COGNANO開発部長)