新型コロナはRNAウイルスであるため、当初から変異型の出現が予想されていました。株式会社COGNANO(京都市左京区、代表取締役CEO・伊村明浩)は、この課題を克服する技術を開発し、4大学との共同研究により、全変異型に対し感染防御活性がきわめて高い抗体を樹立しました。これは、ワクチン接種したアルパカから得られる大量の遺伝子情報を学習し数学的分析によって得られた成果です。オミクロン株出現の1年以上前から、あらゆる変異を克服していた要因は、バイオエキスパートとITエンジニアが協力する体制でした。加えて、クライオ電子顕微鏡解析により、これらの抗体はウイルスタンパク質の深い溝(変異できない弱点)に結合していることが判明しました。また、ウイルスへの結合力が極めて強く安定性も高いため、医学検査ばかりでなく、下水環境中ウイルスの検出にも応用できます。
この研究は、株式会社COGNANO、京都大学、大阪大学、横浜市立大学、東京大学の共同研究チームによって実施され、2022年7月6日に英国科学誌「Communications Biology」にオンライン掲載されました。

1. 背景
新型コロナウイルス感染症(COVID-19)は、2年半以上経った2022年7月現在において収束には至らず、これまでに世界でおよそ7億人が感染し、700万人が亡くなりました。新型コロナウイルス(SARS-CoV-2)は、変異を繰り返して広まり、現在主流である「オミクロン株」は、それまでのVOC(アルファ株、ベータ株、ガンマ株、デルタ株)と比べて、スパイクタンパク質の変異箇所が圧倒的に多く、以前感染した人やワクチン接種者にも感染します。また、オミクロン株による新型コロナウイルス感染症には、出現前に開発された治療用抗体(中和抗体)のほとんどが効かなくなることが明らかになっています。
2. 研究手法・成果
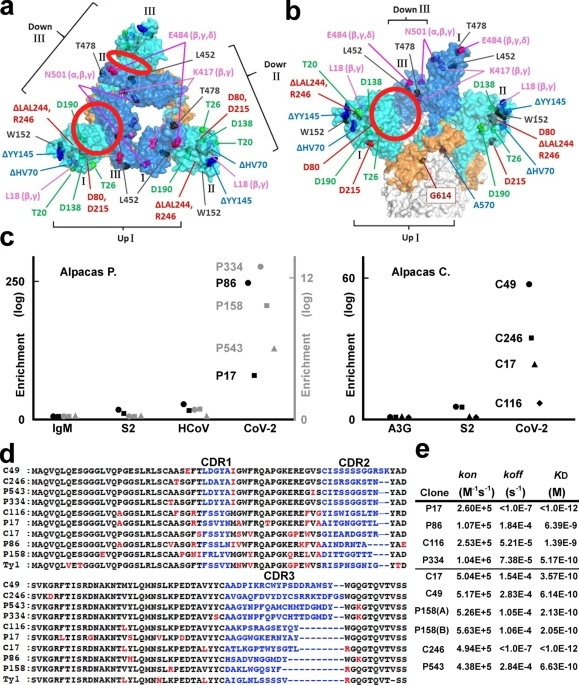
株式会社COGNANO( https://www.cognano.co.jp/)は、RNAウイルスの特徴である変異問題を解決するために、ワクチン接種したアルパカの抗体遺伝子を学習して最適な抗体を選択するアルゴリズム技術を開発しました。このプログラムを駆使し、オミクロン株を含む全ての変異株に対して、これまで使用されてきたどの治療用抗体製剤よりも活性が高いシングルドメイン抗体(ナノボディ)を樹立することに成功しました。さらに、クライオ電子顕微鏡を用いた立体構造解析から、これらのナノボディ抗体が、新型コロナウイルスの表面に存在するスパイクタンパク質の深い溝をエピトープにしていることを示しました。このエピトープはヒトの抗体が到達できない部分であり、ウイルスの変異がほとんど見られない領域です。
論文URL:
成果のポイント
- COGNANO社は、ワクチン接種後に得られるアルパカから有用抗体の遺伝子プロファイルを大量に取得し、候補抗体を識別するプログラムによって、変異型ウイルスにも活性を失わない強力な抗体候補を選び出しました。プロジェクト開始から半年程度で達成できたことは、COGNANO社のコンピュータ創薬アルゴリズムの高速性と有効性を示しています。オミクロン株出現以前から、変異型対応抗体を開発できていたグループが他に存在しないことも、優位性を裏付けています。
動画解説URL: - 京都大学、大阪大学、横浜市立大学、東京大学の共同研究チームは、候補抗体が、現在パンデミックの主流となっている「オミクロン株」を中和することを確認しました。この成果は国立研究開発法人日本医療研究開発機構のアカデミア助成( https://www.amed.go.jp/ )によるものです。
- オミクロン株を代表例とする新型コロナウイルスは、遺伝子変異することにより、ワクチンで誘導された抗体や治療用製剤から逃避可能となります。本研究で創られた抗体は、これまでに報告されたいずれの抗体よりも高い有効性を示しました。
- 本研究で創られたアルパカ抗体は、ヒト抗体の10分の1の大きさです。そのため、ヒト抗体が到達できないスパイクタンパク質の深い溝に入り込むことができます。大阪大学大学院生命機能研究科、大阪大学大学院薬学研究科、大阪大学感染症総合教育研究拠点/微生物病研究所、日本電子株式会社(JEOL)( https://www.jeol.co.jp/ )からなるクライオ電子顕微鏡チームが、スパイクタンパク質に抗体が結合している有様を撮像し、アルゴリズムが選択した抗体が「ウイルスの弱点」に結合していることが証明されました。
この成果は国立研究開発法人日本医療研究開発機構 生命科学・創薬研究支援基盤事業(BINDS)( https://www.binds.jp/ )のご支援によるものです。 - ナノボディ抗体は遺伝子工学による改変がしやすく、通常型抗体よりも安価に生産できます。本抗体は環境耐性が高く、全ての新型コロナウイルス変異株を検出できます。そのため、医学検査ばかりではなく下水環境中のウイルスの濃縮やモニタリングにも利用することができます。
3. 波及効果、今後の予定
ワクチンで誘導される中和抗体や、これまでに開発された治療用抗体は、新型コロナウイルス上のスパイクタンパク質の表面に結合して感染を抑えるものが多いことが知られています。より小型のナノボディ抗体は、スパイクタンパク質の表面よりも奥まった深い溝(本論文では「クレバス」または「隠された裂け目」と呼んでいます)に結合できます。この深い溝には、ヒトの抗体は大きすぎて入り込むことができず、宿主による抗体免疫の選択圧がかからないため、新型コロナウイルスの全ての変異株において、共通の構造を保持している弱点と考えられます。今回開発に成功した創薬セオリーは、新型コロナばかりではなく、エイズ、インフルエンザなどのウイルス変異問題に対する一般的な数学的解決ロジックを示しています。
感染症ばかりではなく、COGNANO社は引き続き、分子標的マーカー未発見のガン(トリプルネガティブ乳がん、膵がん、胆管がん、甲状腺未分化がん、グリオブラストーマなど)を解決するために、Machine Learning、および、バイオテクノロジーを支えるIT基盤技術やプロダクトを開発し、創薬進行中です。また、ナノボディ抗体の優良な物性を利用し、環境水モニタリングや医学検査の開発を行っています。これらの事業も、バイオ情報リソースをITテックとして役立てて社会貢献する機会と捉えています。創薬以外の開発はそれぞれ、公益財団法人・京都産業21「産学公の森」(
https://www.ki21.jp/ )、株式会社アナテック・ヤナコ共同開発( http://yanaco.jp/ )、およびヤマト科学株式会社( https://www.yamato-net.co.jp/ )のご支援によるものです。